前言
通过与酵母细胞壁蛋白融合表达,将目的重组蛋白展示在酵母表面蛋白的方法,称为酵母表面展示。酵母表面展示技术已经成为一种极具价值的蛋白质工程工具,广泛应用于生物技术和生物医学领域。本文将介绍酵母表面展示技术在蛋白工程中的应用。
01亲和力成熟
蛋白质的亲和力对其结合配体而言是一个关键参数,高亲和力有利于调节结合复合物的生物学功能。目前,针对于蛋白质亲和力成熟的方法众多,其中最为常见的是定向进化和分子展示技术。在过去的十年里,酵母表面展示技术逐渐成为亲和力成熟的常用技术。
使用酵母表面展示的亲和力成熟的策略主要包括4个步骤(图1):
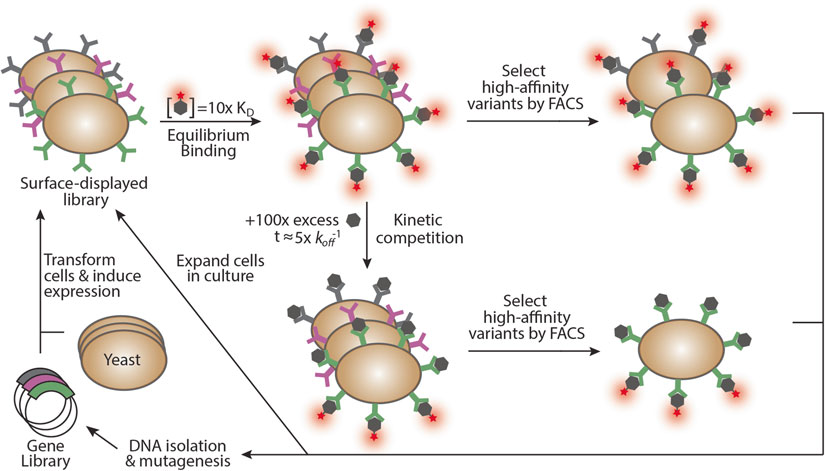
图1:通过FACS从酵母表面展示的文库中分离高亲和性蛋白质突变体.[1]
A. 文库构建:随机诱变产生107-109个蛋白质突变体的文库;
B. 酵母表面展示:基因库转化酵母细胞和诱导表面表达,蛋白质突变体表现为与Aga2p细胞壁蛋白的融合体;
C. 利用蛋白配体对展示文库进行差异标记(两种策略):平衡结合策略与动力学结合策略,蛋白质突变体由于亲和性不同而导致配体结合产生差异;
D. FACS筛选:添加经荧光标记的抗表位标签抗体可使酵母表面表达水平随结合而正常化,从而可通过FACS分离出高亲和性的突变体;
经分选的酵母克隆可扩增培养以用于分析或后续一轮分选,或可分离提取DNA,经突变后用于转化新批次的酵母细胞以进行进一步的蛋白定向进化,从而筛选出更高亲和力的蛋白。
02蛋白稳定性高
蛋白质的稳定性通常是指其抵抗热变性和化学变性以及蛋白水解降解的能力。高稳定性是用于研究工业和治疗应用的蛋白质的期望特征,同时稳定性的提升可转化为更长的保存期、活性持续时间和体内活性。与结合亲和力一样,酵母表面展示技术可以在蛋白质突变体仍与酵母细胞表面相连的情况下分析热稳定性,从而可以快速、定量地测定最大变性(TM)值。
目前,酵母平台主要利用三种策略工程化增加蛋白质的稳定性(图2)。三种方法均先通过随机诱变产生约107至109个蛋白质突变体文库,并将其作为与Aga2p细胞壁蛋白的融合物进行酵母表面展示,随后分策略进行高稳定性蛋白质的筛选。
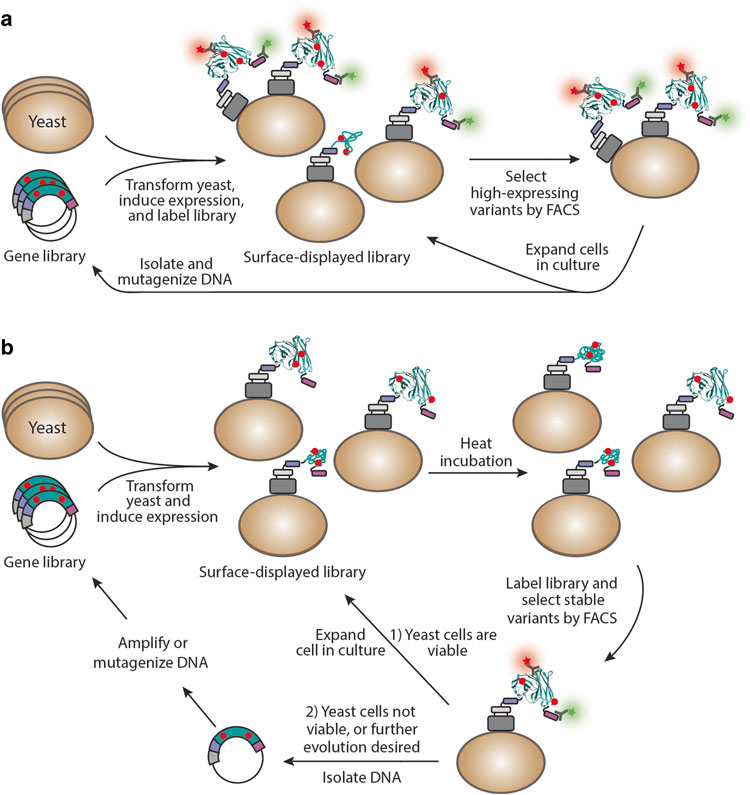
图2:通过FACS从酵母表面展示的文库中分离高稳定性蛋白质突变体(点突变显示为红色)[1]
策略一:根据表面表达水平筛选稳定的蛋白质突变体(图2a)。用突变基因库转化酵母通常会显示出适当折叠和截短的蛋白质突变体,其表达水平在一定范围内,可用作蛋白质稳定性的替代物。用针对c - myc表位标签(紫色框)的荧光抗体(绿色星)和对酵母表面展示蛋白的天然折叠特异的配体(红色星)标记细胞,再通过FACS选择表达最高水平的正确折叠突变体的细胞。
策略二:根据其抵抗不可逆热变性的能力筛选稳定的蛋白质突变体(图2b) 。在细胞分选前对酵母表面展示文库进行高温热应激(85℃,10分钟)。高温热变性一般属于不可逆变性,故此法更适合于具有较高热稳定性的蛋白质。基于其与荧光标记的抗体或配体结合的能力,通过FACS分选出特异于天然蛋白质折叠的,可抵抗热变性的酵母表面展示的突变体。
策略三:利用升高温度的优势和内质网(ER)的质量控制机制来选择稳定的突变体。在该方法中,在高达37℃(与通常使用的20℃或30℃相比)的温度下诱导表面展示的蛋白质表达24小时,以在蛋白质合成期间利用ER对蛋白质的翻译后处理,使蛋白质结构的平衡向错误折叠状态转移,同时保持酵母细胞的活力。一般来说,只有在升高的诱导温度下有效折叠和加工的蛋白质才能避开ER质量控制机制并有效地转运到细胞表面。然后可以如第一种策略(图2a)所述对文库进行分类,以选择稳定性增加的突变体。
03蛋白酶定向进化
定向进化是改造酶特性的一项强有力的技术。然而,酶的定向进化过程中最大的挑战则是将酶突变体的基因型与其表型(例如,催化活性或底物特异性)正确联系,因为在大多数情况下,底物转换产生的是可扩散的产物,无法共价结合到噬菌体或细胞的表面,而酵母表面展示技术可将酶突变体与锚定蛋白如a-凝集素融合表达,而锚定于酵母细胞壁上。随着酵母表面展示技术的发展,结合FACS技术可以对包含108个酶突变体的文库进行筛选,获得更高活性和底物特异性的酶。
其中,用于酶催化邻近标记的生物素连接酶TurboID就是通过酵母表面展示定向进化筛选获得的。科学家Tess C. Branon等人[2]以生物素连接酶BioID(BirA-R118S) 为模板,使用易错PCR技术合成一个包含有107个连接酶突变体的文库,每个连接酶突变体平均有两个氨基酸的突变。将该连接酶突变体文库展示在酵母表面,加入生物素和ATP启动杂交生物素化,然后用链霉亲和素对每个酵母细胞表面的生物素化部位进行染色。通过流式分选富集高度自我生物素化的细胞(图3)。
科学家通过这种酵母表面展示定向进化生物素连接酶,经过多轮筛选最终获得更高效率的生物素连接酶突变体TurboID和miniTurbo,这两种酶使得酶催化标记反应可在10分钟内完成,大大缩短生物素标记实验周期且提高标记效率。
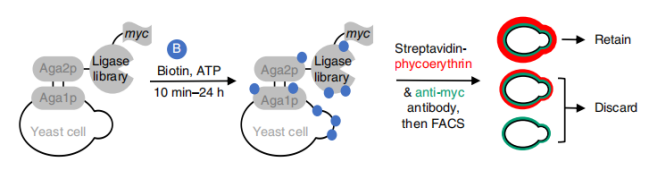
图3. 基于酵母表面展示定向进化的选择方案。[2]
连接酶与锚定蛋白Aga2p融合表达,Aga2p通过二硫键与Aga1p共价结合锚定在酵母表面。连接酶的C-末端带有myc表达标签。将生物素和ATP加入到酵母库中反应10分钟到24小时。蓝色圆点所示为生物素化标记的位点。用链霉亲和素染色检测底物的生物素化程度,用anti-myc抗体染色检测连接酶的表达。FACS分选富集链霉亲和素和Myc染色高比例的细胞。
小结
与核糖体和噬菌体展示等其他技术相比,酵母表面展示的最显著优势是可以结合流式细胞仪分析使用,能够在细胞上定量测量蛋白表达水平、稳定性、亲和力和特异性,而不需要可溶性蛋白表达和纯化等步骤。此外,酵母表面展示是真核表达系统,能够产生含有多个二硫键的复杂哺乳动物蛋白质。这种独特的优势组合使酵母表面展示技术成为应用于蛋白改造中的领先技术。
阿帕克生物酵母表面展示技术平台在蛋白改造中的应用介绍
阿帕克生物专注于纳米抗体研发,将酵母展示技术应用于抗体发现及蛋白质工程等领域,并提供抗体发现、抗体亲和力成熟、T细胞受体亲和力提高等服务,经验丰富,欢迎咨询。
蛋白改造案例分享
1.IL-2:
白细胞介素2 (Interleukin 2,IL-2)是细胞因子的一种,在免疫系统中起重要作用。它是一种负责调节白细胞(白细胞,通常是淋巴细胞)的免疫活性的蛋白质。IL-2的生成是机体受微生物感染时免疫应答的一部分,以区别“自己”与“非己”。IL-2通过与淋巴细胞表面的IL-2 受体(IL-2R)结合来发挥作用。
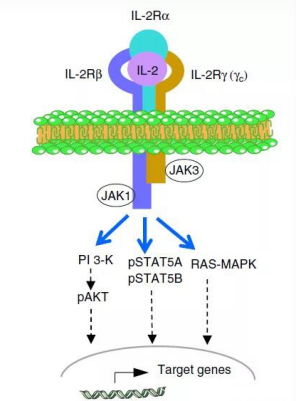
图4:IL-2与IL-2R信号传导通路
NK 细胞是唯一正常情况下表达 IL-2R 的淋巴样细胞,因此始终对 IL-2 保持反应性。然而非活化的 NK 细胞上只表达 IL-2R 的β链和γ链,对 IL-2 的亲和力低,只对高浓度的 IL-2 发生反应。一旦 NK 细胞活化,就表达 IL-2R 的α链,成为高亲和力的受体;大剂量的 IL-2 能诱导出一种非特异性的杀伤细胞-LAK细胞(淋巴因子激活的杀伤细胞,lymphokine active killer cell),可杀伤对NK细胞抵抗的肿瘤细胞。为了从文库中筛选出与IL2-Rβ/γ相互作用,同时与IL2-Ra不识别或低亲和的克隆,基于酵母表面展示平台,我们在筛选策略上进行了针对性的调整。最终经过几轮筛选后,获得目标克隆。以下为野生型及筛选后的比对结果:
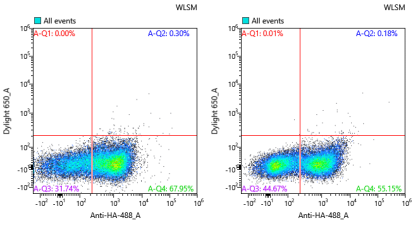
图5:产物鉴定-同型对照(左:WT右:筛选对照)
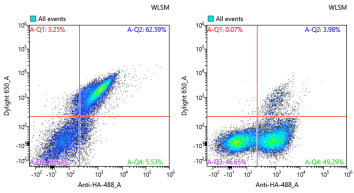
图6:产物鉴定-孵育Ra(左:WT ;右:筛选克隆鉴定)
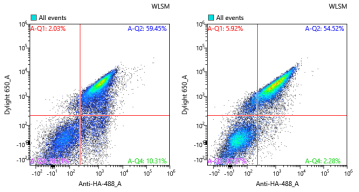
图7:产物鉴定-孵育Rb(左:WT ;右:筛选克隆鉴定)
最终经单克隆鉴定,成功筛选得到与IL-2Ra不结合,并与IL-2Rβ/γ保持相互作用的克隆。
2. IL-18
细胞因子是在晚期癌症患者中产生持久反应的现代免疫疗法,但它们只有适度的疗效和有限的耐受性。研究表明白细胞介素-18(IL-18)通路的成分在肿瘤膨胀的淋巴细胞上上调,这说明IL-18治疗可以增强抗肿瘤免疫。然而,有研究发现IL-18BP,一种高强度的IL-18诱饵受体,在不同的人类和小鼠肿瘤中经常上调,并限制了IL-18在小鼠中的抗肿瘤活性。
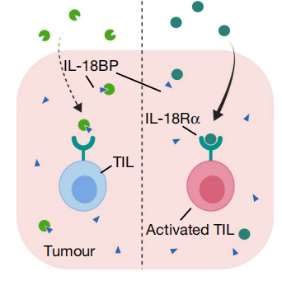
图8:IL-18BP可高强度结合白细胞介素-18
为了降低IL-18与IL-18BP的结合,需要通过改造,设计一种可抵抗IL-18BP,且保持信号传导潜力,但不受IL-18BP抑制的影响的蛋白。
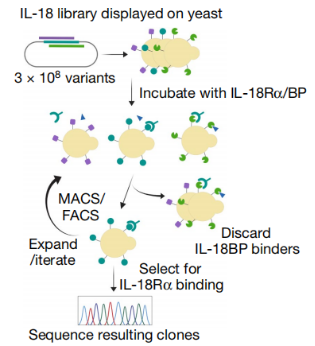
图9:弱结合IL-18BP筛选示意流程图
我们通过定向突变得到一个合成文库,将合成的突变文库诱导展示在酵母细胞上,进行几轮筛选得到目标克隆,最终分选得到几乎不与IL-18BP结合的克隆,诱导其进行表达并对产物进行鉴定,结果如下:
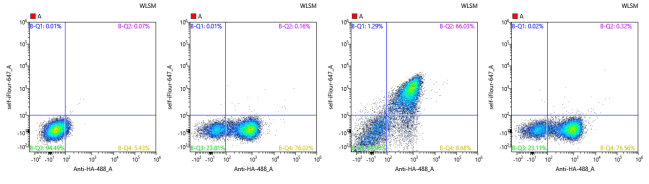
图10:产物鉴定结果Blank/同型对照/IL-18Ra与IL-18Rb染色/IL-18BP染色。
BP的阳性率(左四)与Ra的阳性率(左三)出现明显差别,存在一群明显不识别BP蛋白的细胞群,同时对Ra维持较高的结合。
参考资料:
[1]. Gerald M., et al. Applications of Yeast Surface Display for Protein Engineering. Yeast Cell Surface Dispaly, Methods,Protocols, and Applications; Bin Liu, Ed.; Springer, 2015, pp.155-170. doi.10.1007/978-1-4939-2748-7_8
[2]. Branon, Tess C et al. Efficient proximity labeling in living cells and organisms with TurboID.Nature biotechnology vol. 36,9 (2018): 880-887. doi:10.1038/nbt.4201
了解更多纳米抗体相关内容,可关注<阿帕克生物>微信公众号,获取最新资讯~
